创新医疗器械注册申报流程
摘要:
展开>>
收起<<
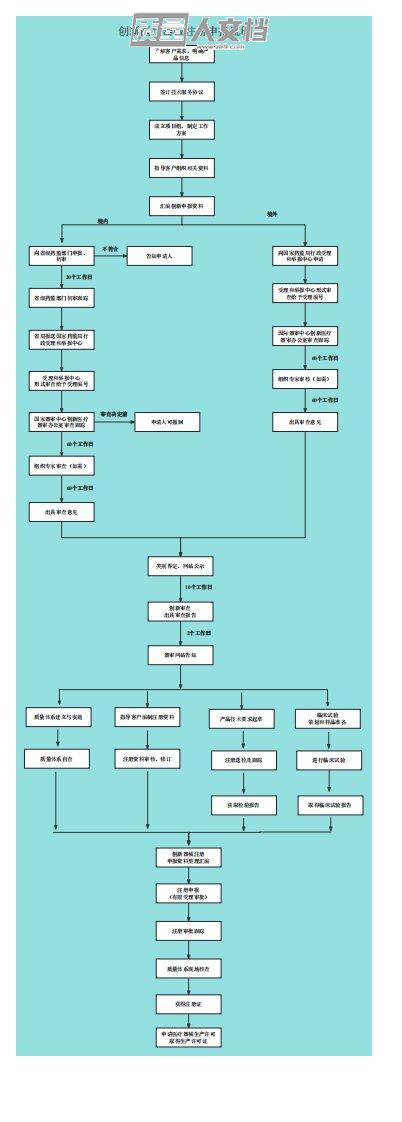
创新医疗器械注册申报流程了解客户需求,明确产品信息签订技术服务协议成立项目组,制定工作方案指导客户组织相关资料汇编创新申报资料向省级药监部门申报、初审向国家药监局行政受理和举报中心申请境外境外省级药监部门初审跟踪受理和举报中心形式审查给予受理编号省局报送国家药监局行政受理和举报中心境内境内不符合不符合告知申请人受理和举报中心形式审查给予受理编号20个工作日个工作日国家器审中心创新医疗器审办公室审查跟踪申请人可撤回审查决定前审查决定前组织专家审查(如需)60个工作日个工作日60个工作日个工作日出具审查意见国际器审中心创新医疗器审办公室审查跟踪组织专家审核(如需)出具审查意见60个工作日个工作日6...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
质量管理制度及流程记录表格汇总

 2024-04-28 191
2024-04-28 191 -
8D报告()

 2024-05-04 75
2024-05-04 75 -
可用性文档自查表VIP免费
 2024-11-11 185
2024-11-11 185 -
RD-FM-017 医疗器械技术文档VIP免费

 2025-08-05 26
2025-08-05 26 -
RD-FM-015 特殊过程确认方案和报告VIP免费
 2025-08-05 64
2025-08-05 64 -
风险管理报告(模板)VIP免费

 2025-08-06 37
2025-08-06 37 -
RD-FM-029 Rev.01 生物相容性评价报告VIP免费

 2025-08-07 22
2025-08-07 22 -
RD-FM-023 医疗器械安全和性能基本原则清单VIP免费
 2025-08-07 145
2025-08-07 145 -
RD-FM-022 Rev. 01 风险管理报告VIP免费

 2025-08-07 26
2025-08-07 26 -
RD-FM-021 Rev. 01 风险管理计划VIP免费

 2025-08-07 29
2025-08-07 29
作者: 51zlzl
分类:专业资料
价格:免费
属性:1 页
大小:47.51KB
格式:PDF
时间:2024-05-02


