《北京市医疗器械审评核查咨询问答 300 问》-下册



标签: #医疗器械
摘要:
展开>>
收起<<
《北京市医疗器械审评核查咨询问答300问》(下册)发布时间:2023年07月05日第一篇有源产品201.第二类独立软件产品删减部分非核心临床功能是否需要补检?答:如果删减部分非核心临床功能不影响医疗器械安全性与有效性,这种情况属于轻微软件更新,一般不需要补检。如果删减部分非核心临床功能影响医疗器械安全性与有效性,则属于重大软件更新,这种情况一般需要进行补检。202.第二类有源产品的研发过程中何时需要进行联合使用的研究?答:如申报产品预期与其他医疗器械、药品、非医疗器械产品联合使用实现同一预期用途,应提供证明联合使用安全有效的研究资料,包括互联基本信息(连接类型、接口、协议、最低性能)、联合使用...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
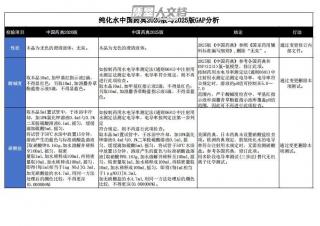
纯化水中国药典2020版与2025版GAP分析VIP免费
 2025-04-18 267
2025-04-18 267 -
无菌检查法对比表(2025版药典 VS 2020版药典)

 2025-09-27 240
2025-09-27 240 -
1101无菌检查法对比表(2025版药典 VS 2020版药典)
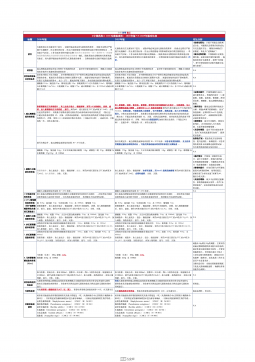
 2025-09-29 182
2025-09-29 182 -
1143 细菌内毒素检查法对比表(2025版药典 VS 2020版药典)

 2025-09-29 446
2025-09-29 446 -
ECA-污染控制策略指南(中英文)-202202VIP免费

 2025-11-04 45
2025-11-04 45 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(中英文对照版)VIP专享

 2025-11-06 347
2025-11-06 347 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(英文版)VIP免费

 2025-11-06 95
2025-11-06 95 -
PDA-TR49-生物清洁验证-中英文翻译

 2025-11-19 38
2025-11-19 38 -
ISPE 除热原隧道的验证alidation of a Depyrogenation Tunnel-2025(中英文)VIP免费

 2025-11-25 29
2025-11-25 29 -
药包材GMP培训2025VIP免费

 2025-12-04 22
2025-12-04 22
作者:胖子
分类:专业资料
价格:免费
属性:24 页
大小:438.24KB
格式:PDF
时间:2024-09-08


