医疗器械设计开发控制指南
VIP免费
*****************************
**医疗器械设计开发控制指南**
*****************************
第三版
The Third Edition
作者:Marie B. Teixeira
翻译:MEDPAK 翻译团队
免责声明:本书著作权归 Marie B. Teixeira 所有,本团队仅作翻译交流,便于同行朋友交流
学习之用。因团队水平有限,翻译有不当之处,请大家谅解。译本不可作为任何商业用
途,包含印刷作为宣传册等资料。敬请谅解。
Disclaimer:The copyright of this book is belonging to Marie B. Teixeira. We just translate it into
Chinese language. The purpose of this book is that the exchanges between the medical device
industry. Thanks for understanding of not clear in the copy for my team limited ability. Any
business purposes are forbidden, including nonprofit brochure. Thanks for your cooperation.
医疗器械设计开发控制指南
i
序言
自从 1997 年6月美国食品药品监督管理局(FDA)的质量体系条例
(QSR)正式强制要求设计控制要求,并且对国际标准 ISO 13485 进行了多次
修订,因此对符合设计控制要求的期望不断发展。此外,随着监管机构越来越
注重保证产品的安全性和有效性,几年前可能被认为可以接受的东西现在可能
不再被接受。因此,公司的设计开发控制程序本质上应该是动态的,并根据当
前的标准和行业实践不断发展。
很难相信这本书第一次出版已经超过 16 年了,虽然设计控制要求在这段时
间没有发生显著变化,但我参与 FDA 和公告机构的审核意味着证明合规性所需
的交付成果已经变化。在过去的 20 年里,我一直负责实施质量管理体系以满足
国内和国际要求,并担任医疗器械制造商的顾问,我受益于为所有类型的公司
工作,无论大小,制造 范围广泛的器械和使用不同的设计控制系统。这次接触
使我能够开发实用的方法来满足标准要求并遵守外部监管机构的要求。
我编写第三版的主要目标是使本书在设计控制要求方面保持最新状态,并
在用于符合第三方合规性期望的方法方面保持最新状态。在第三版中,本书的
范围已更新,以解决 ISO 13485:2016 对设计控制的要求,并参考相关的医疗
器械单一审核程序(MDSAP)设计控制要求。本书还进行了重大修订,以便为
理解和实施设计概念提供更多细节。此外,大多数附录已被修订或替换为更新
的模板。
在诸如此类的书中,它涵盖了适用于广泛医疗器械和公司的设计开发控制
要求,通常很难甚至不可能包含对要求的所有意见或解释,或者以解决问题的
方式呈现每个人的具体情况。鉴于这种多样性,本书的目的是对设计控制要求
进行实际评审,并提供实用且经过验证的工具和技术,以满足设计开发控制要
求和第三方审核员/调查员的期望。制造商可以并且应该寻求将设计开发控制应
用于其特定情况的特定技术指南。
医疗器械设计开发控制指南
ii
关于作者
Marie B. Teixeira 是佛罗里达州 Odessa 市的 QA/RA Compliance Connection,
Inc.的创始人和首席顾问。QARACC 是一家世界级的咨询公司,在全球质量管
理和法规事务的各个方面为其客户提供专家指导。在她的指导下,她的客户获
得了 ISO 9001、ISO 13485、CE 和MDSAP 认证,并获得了国际医疗器械监管
许可。
在开始这家企业之前,她是 Bioderm, Inc.的质量保证和法规事务总监,
Bioderm, Inc.是佛罗里达州坦帕湾的一家初创医疗器械公司,她为该公司设计、
指导和实施了质量体系的政策和程序。公司满足全球监管要求。
Teixeira 女士还在佛罗里达州拉戈的 Smith & Nephew 伤口管理部门担任监
管事务质量系统经理。除了指导 Smith & Nephew 的ISO 13485、FDA GMP 和
MDD 93/42/EEC 监管工作的规划、开发和实施之外,她还实施并指导了公司的
内部审计计划和管理评审系统。正是在她的指导下,Smith & Nephew 的创伤管
理部门在不到一年的时间内获得了 ISO 认证,并在一年后获得了 MDD 认证。
Teixeira 女士的职业生涯始于雷神公司、GTE 政府系统和 Sparton
Electronics 的质量工程师。在这些公司任职期间,她负责制定和实施质量保证
计划和程序、领导供应商和客户审核、开发和执行质量体系和审核员培训、启
动和管理纠正及预防措施以及制定和实施供应商认证计划。在 Sparton 任职期
间,她领导团队通过初始的 ISO 认证和日常的监督审核。
Marie Teixeira 拥有马萨诸塞大学阿默斯特分校的工业工程和运筹学学士学
位。她是美国质量协会的成员。Teixeira 女士是一名获得 ASQ(美国质量协
会)认证的质量经理和质量工程师,以及模范全球首席审计师。Teixeira 女士还
是国际标准工作小组 CEN/TC257/SC-DETG10 的活跃成员,该工作小组的目标
是标准化医疗器械命名法。Teixeira 女士最近撰写了她的第三版《医疗器械设计
开发控制指南》一书。她还出版了许多与质量体系相关的 CD-ROM 培训模块和
相关信息手册,并举办了多次质量体系培训研讨会。
摘要:
展开>>
收起<<
*******************************医疗器械设计开发控制指南*******************************第三版TheThirdEdition作者:MarieB.Teixeira翻译:MEDPAK翻译团队免责声明:本书著作权归MarieB.Teixeira所有,本团队仅作翻译交流,便于同行朋友交流学习之用。因团队水平有限,翻译有不当之处,请大家谅解。译本不可作为任何商业用途,包含印刷作为宣传册等资料。敬请谅解。Disclaimer:ThecopyrightofthisbookisbelongingtoMarieB.Teixeira.Wejusttran...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
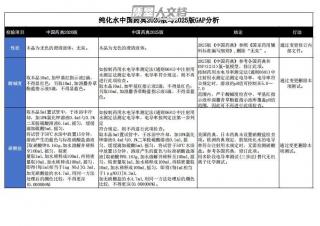
纯化水中国药典2020版与2025版GAP分析VIP免费
 2025-04-18 273
2025-04-18 273 -
无菌检查法对比表(2025版药典 VS 2020版药典)

 2025-09-27 263
2025-09-27 263 -
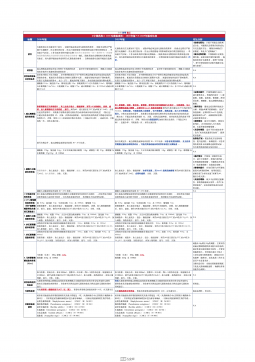
1101无菌检查法对比表(2025版药典 VS 2020版药典)
 2025-09-29 197
2025-09-29 197 -
1143 细菌内毒素检查法对比表(2025版药典 VS 2020版药典)

 2025-09-29 466
2025-09-29 466 -
ECA-污染控制策略指南(中英文)-202202VIP免费

 2025-11-04 48
2025-11-04 48 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(中英文对照版)VIP专享

 2025-11-06 354
2025-11-06 354 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(英文版)VIP免费

 2025-11-06 101
2025-11-06 101 -
PDA-TR49-生物清洁验证-中英文翻译

 2025-11-19 42
2025-11-19 42 -
ISPE 除热原隧道的验证alidation of a Depyrogenation Tunnel-2025(中英文)VIP免费

 2025-11-25 31
2025-11-25 31 -
药包材GMP培训2025VIP免费

 2025-12-04 23
2025-12-04 23
作者:胖难瘦
分类:专业资料
价格:50质量币
属性:198 页
大小:12.18MB
格式:PDF
时间:2024-04-12


