欧洲药典EP11.0-2.6.1无菌检查(中文版)


摘要:
展开>>
收起<<
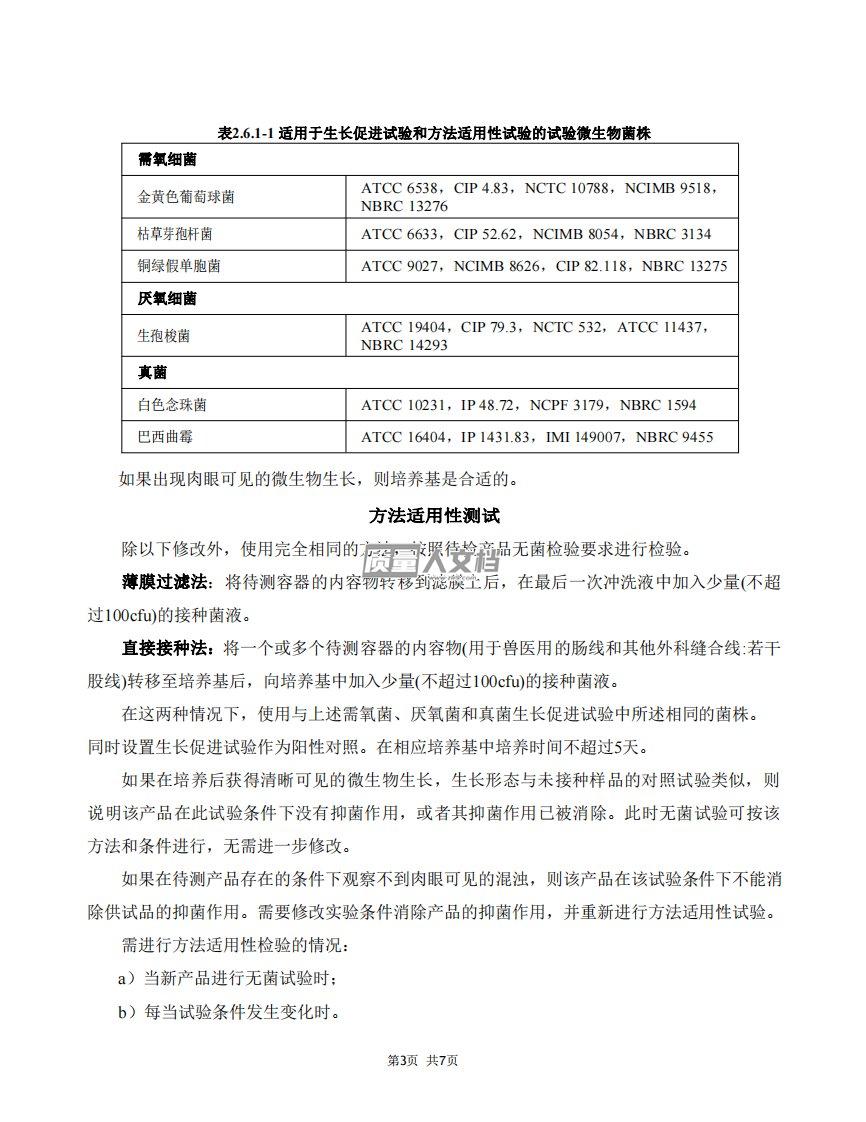
第1页共7页EP2.6.1无菌检查法该试验适用于检查药典要求无菌的药物、制剂产品或其他物品是否无菌的一种方法。然而,合格的结果仅表明在该试验条件下样品中未发现微生物污染。预防微生物污染的措施无菌检查应在无菌条件下进行。为了达到该条件,试验环境必须达到无菌检查的要求。防止污染采取的措施应确保不会影响供试品中微生物的检出。通过对工作区域进行适当取样并进行适当控制,来定期监控进行试验的工作条件。培养基和培养温度用于试验的培养基可按如下所述制备,或可使用等效的商业培养基,只要它们符合生长促进试验的要求。以下培养基已被证实适用于无菌试验。硫乙醇酸盐流体培养基主要用于厌氧菌的培养。但其也可用于需氧菌培养。...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
关于2020年版《中国药典》勘误的通知

 2024-04-12 56
2024-04-12 56 -
《计算机化系统验证指南》VIP免费

 2024-04-13 64
2024-04-13 64 -
数据完整性和合规性与药物CGMP问题与解答

 2024-04-18 107
2024-04-18 107 -
新版兽药GMP条条看

 2024-04-29 48
2024-04-29 48 -
2023GMP指南 质量控制实验室

 2024-05-01 99
2024-05-01 99 -
药品共线生产质量风险管理指南解读VIP免费

 2024-05-17 51
2024-05-17 51 -
无菌药品生产污染控制策略技术指南_征求意见稿

 2024-09-14 43
2024-09-14 43 -
纯化水中国药典2020版与2025版GAP分析VIP免费
 2025-04-18 189
2025-04-18 189 -
2025 无菌检查法新旧版本对比表VIP免费

 2025-04-18 314
2025-04-18 314 -
1101无菌检查法对比表(2025版药典 VS 2020版药典)
 2025-09-29 63
2025-09-29 63
作者:多多猪
分类:专业资料
属性:7 页
大小:225.45KB
格式:PDF
时间:2025-07-23


