MDR实施医疗器材欧盟法规-20181019
VIP免费

标签: #MDR
摘要:
展开>>
收起<<
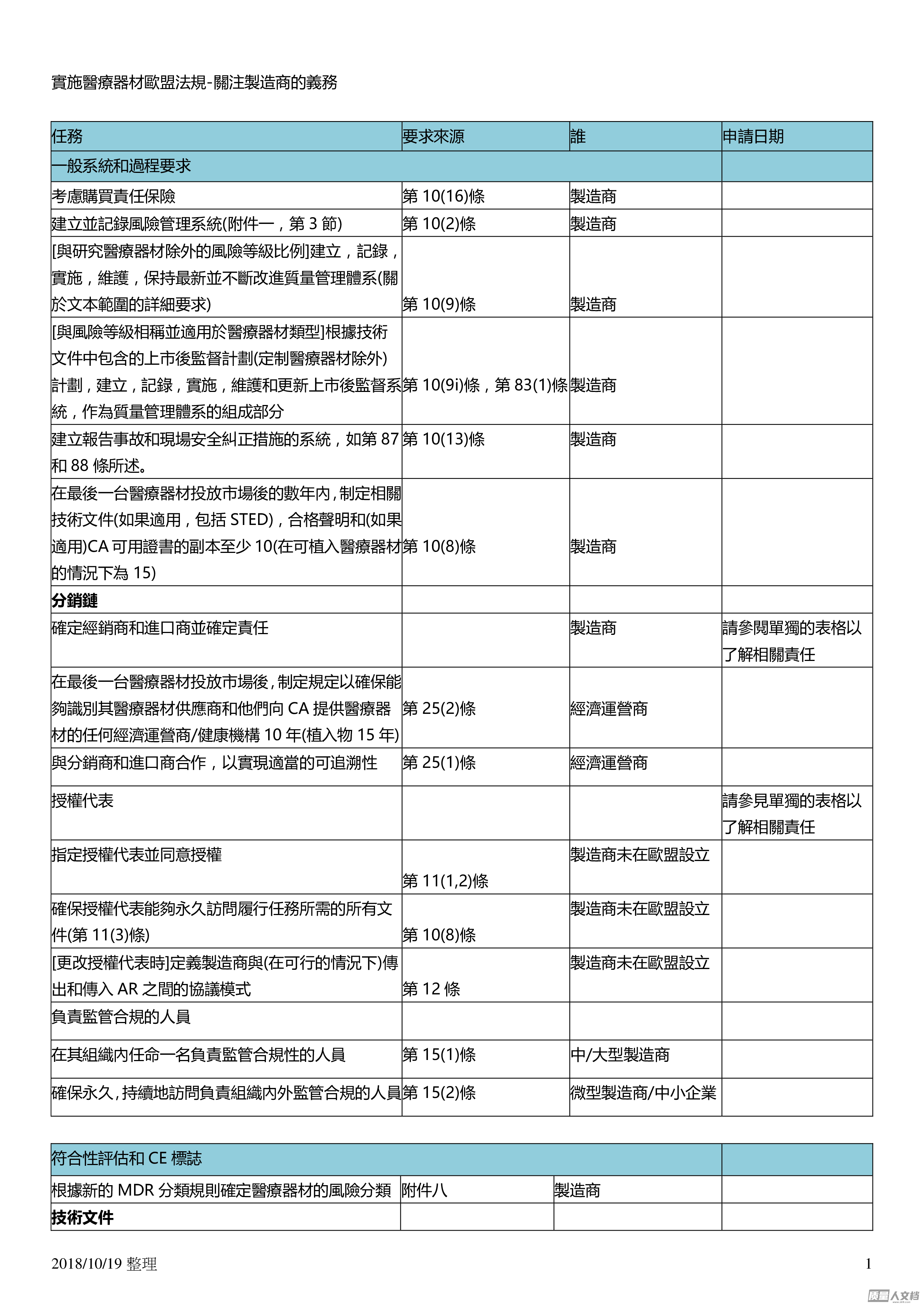
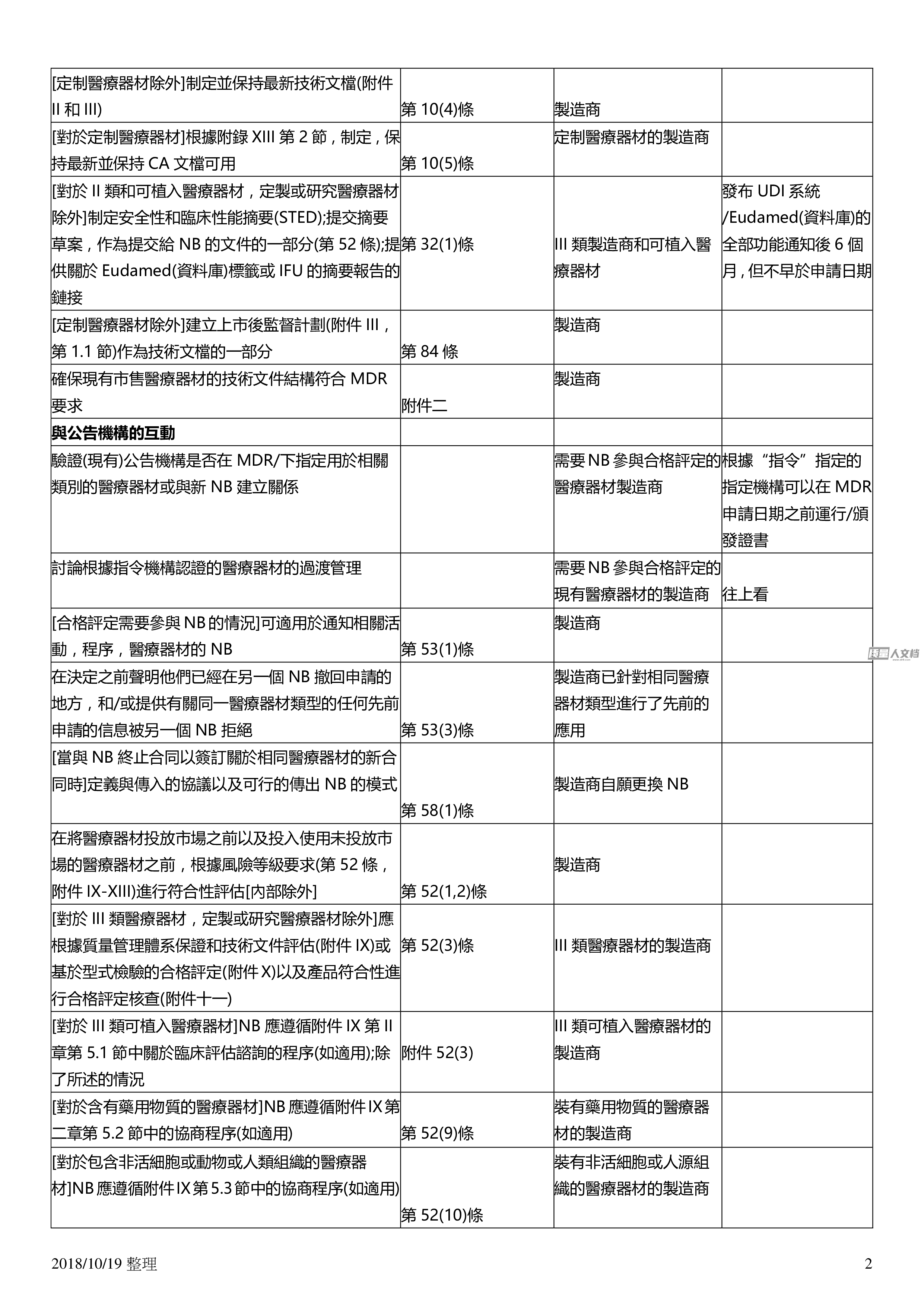
20181019整理1實施醫療器材歐盟法規關注製造商的義務任務要求來源誰申請日期一般系統和過程要求考慮購買責任保險第1016條製造商建立並記錄風險管理系統附件一第3節第102條製造商與研究醫療器材除外的風險等級比例建立記錄實施維護保持最新並不斷改進質量管理體系關於文本範圍的詳細要求第109條製造商與風險等級相稱並適用於醫療器材類型根據技術文件中包含的上市後監督計劃定制醫療器材除外計劃建立記錄實施維護和更新上市後監督系統作為質量管理體系的組成部分第109i條第831條製造商建立報告事故和現場安全糾正措施的系統如第87和88條所述。第1013條製造商在最後一台醫療器材投放市場後的數年內制定相關技術...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
关于2020年版《中国药典》勘误的通知

 2024-04-12 56
2024-04-12 56 -
《计算机化系统验证指南》VIP免费

 2024-04-13 63
2024-04-13 63 -
数据完整性和合规性与药物CGMP问题与解答

 2024-04-18 107
2024-04-18 107 -
新版兽药GMP条条看

 2024-04-29 48
2024-04-29 48 -
2023GMP指南 质量控制实验室

 2024-05-01 99
2024-05-01 99 -
药品共线生产质量风险管理指南解读VIP免费

 2024-05-17 51
2024-05-17 51 -
无菌药品生产污染控制策略技术指南_征求意见稿

 2024-09-14 43
2024-09-14 43 -
纯化水中国药典2020版与2025版GAP分析VIP免费
 2025-04-18 189
2025-04-18 189 -
2025 无菌检查法新旧版本对比表VIP免费

 2025-04-18 313
2025-04-18 313 -
1101无菌检查法对比表(2025版药典 VS 2020版药典)
 2025-09-29 63
2025-09-29 63
作者:胖子
分类:法规规范
属性:11 页
大小:469.89KB
格式:PDF
时间:2024-05-13


