体外诊断设备注册申报资料要求
摘要:
展开>>
收起<<
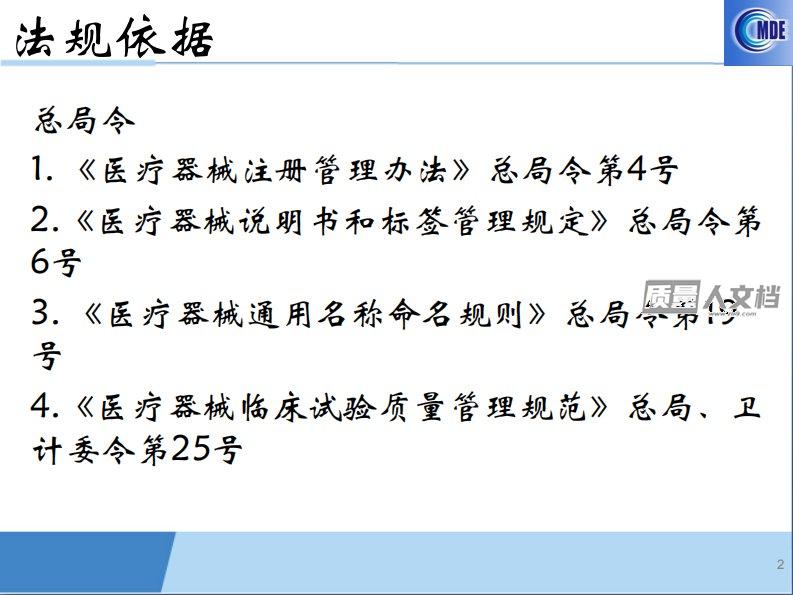
体外诊断设备注册申报资料要求2017.3北京1法规依据总局令1.《医疗器械注册管理办法》总局令第4号2.《医疗器械说明书和标签管理规定》总局令第6号3.《医疗器械通用名称命名规则》总局令第19号4.《医疗器械临床试验质量管理规范》总局、卫计委令第25号2法规依据规范性文件1.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)2.关于发布医疗器械产品技术要求编写指导原则的通告(2014年第9号)3.关于发布免于进行临床试验的第二类医疗器械目录的通告(2014年第12号)4.关于发布免于进行临床试验的第三类医疗器械目录的通告(2014年第13号)5.关于发布第二批免于进...
相关推荐
-
GB∕T 16886.12-2023 医疗器械生物学评价 第12部分:样品制备与参照材料VIP免费

 2024-04-14 46
2024-04-14 46 -
GB∕T 14233.1-2022 医用输液、输血、注射器具检验方法 第1部分:化学分析方法

 2024-04-16 85
2024-04-16 85 -
GB∕T 2828.3-2008 计数抽样检验程序 第3部分:跳批抽样程序

 2024-04-17 22
2024-04-17 22 -
GB∕T 25915.2-2021 洁净室及相关受控环境 第2部分:洁净室空气粒子浓度的监测

 2024-04-17 72
2024-04-17 72 -
GB∕T 19973.1-2023 医疗保健产品灭菌 微生物学方法 第1部分:产品上微生物总数的确定

 2024-04-18 25
2024-04-18 25 -
GB 2761-2017 食品安全国家标准 食品中真菌毒素限量VIP免费

 2024-04-19 21
2024-04-19 21 -
GB∕Z 42217-2022 医疗器械 用于医疗器械 质量体系软件的确认VIP免费

 2024-04-19 33
2024-04-19 33 -
GB∕T 42125.10-2022测量、控制和实验室用电气设备的安全要求 第10部分:绝缘电阻测量和介电强度试验设备的特殊要求VIP免费

 2024-04-19 24
2024-04-19 24 -
GB∕T 42062-2022 医疗器械 风险管理对医疗器械的应用VIP免费

 2024-04-19 46
2024-04-19 46 -
GB∕T 35770-2022 合规管理体系 要求及使用指南VIP免费

 2024-04-19 57
2024-04-19 57
作者:宁静致远
分类:培训考试
属性:91 页
大小:2.81MB
格式:PDF
时间:2024-05-20