医疗器械临床研究的伦理审查与知情同意--袁斌华


标签: #医疗器械
摘要:
展开>>
收起<<
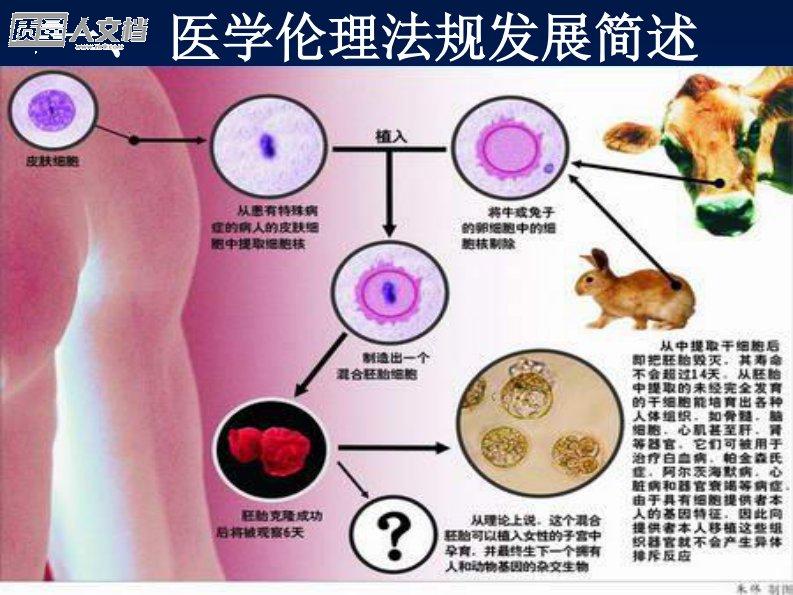
医疗器械临床研究的伦理审查与知情同意深圳市药品监督管理局医疗器械监管处袁斌华yuanbinhua@szda.gov.cnyfyuan81@hotmail.com2012一、医学伦理法规发展简述1、实验动物福利与保护•从1822年开始英国提出了应该:用尽可能少的动物数;并且是以尽可能少给试验动物带来痛苦的方式来进行动物实验。对动物尚且如此,那么对待我们人类自身呢?2、《纽伦堡法典》-伦理原则的确立二战期间,德国纳粹医生以科学研究为名,进行了一系列惨无人道的人体试验。1946~1947年盟军在纽伦堡为了寻找审判纳粹医生的法律依据,特制定了《纽伦堡法典》-第一部医学研究伦理法典:主要包含10条基本伦...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
IVD产品设计开发以及注册申报流程图VIP免费

 2024-04-12 148
2024-04-12 148 -
医疗器械设计开发控制指南VIP免费

 2024-04-12 220
2024-04-12 220 -
YY∕T 0664-2020医疗器械软件软件生存周期过程核查表VIP免费

 2024-04-12 202
2024-04-12 202 -
创新医疗器械注册申报流程

 2024-05-02 110
2024-05-02 110 -
20221028_医疗器械生产现场核查缺陷分析交流(江苏药省监局审核查验中心) (1)VIP免费

 2024-05-09 73
2024-05-09 73 -
医疗器械网络安全漏洞自评报告VIP专享

 2024-11-18 263
2024-11-18 263 -
内审检查表 MDR法规VIP免费

 2025-04-07 157
2025-04-07 157 -
国产三类医疗器械首次注册-申报前准备工作VIP免费
 2025-09-03 19
2025-09-03 19 -
国产三类医疗器械首次注册-申报流程VIP免费
 2025-09-03 23
2025-09-03 23 -
国产三类医疗器械变更注册VIP免费
 2025-09-03 18
2025-09-03 18
作者:这个名字不太冷
分类:专业资料
属性:47 页
大小:2.64MB
格式:PDF
时间:2024-05-01


