医疗器械的人类受试者临床研究-临床试验质量管理规范 ISO 14155-2020翻译稿
VIP免费
欧洲标准 EN ISO 14155
2020 年 8 月
ICS 11.100.20 取代 EN ISO 14155:2011
中文版
医疗器械的人类受试者临床研究-临床试验质量管理规范(ISO 14155:2020)
本欧洲标准于 2020 年 5 月 2 日获得 CEN 批准。
CEN 成员必须遵守 CEN/CENELEC 内部条例,其中规定了赋予本欧洲标准国家标准地位的
条件,无任何变更。可以向 CEN-CENELEC 管理中心或任何 CEN 成员申请获得关于此类
国家标准的最新列表和参考文献。
本欧洲标准现有三种官方版本(英文版、法文版、德文版)。由 CEN 成员国负责翻译
成其本国语言并通知 CEN-CENELEC 管理中心,任何其他语言版本与官方版本具有相同
的法律效力。
CEN 成员是指下列各国的国家标准机构:奥地利、比利时、保加利亚、克罗地亚、塞浦
路斯、捷克共和国、丹麦、爱沙尼亚、芬兰、法国、德国、希腊、匈牙利、冰岛、爱
尔兰、意大利、拉脱维亚、立陶宛、卢森堡、马耳他、荷兰、挪威、波兰、葡萄牙、
北马其顿共和国、罗马尼亚、塞尔维亚、斯洛伐克、斯洛文尼亚、西班牙、瑞典、瑞
士、土耳其和英国。
欧洲标准化委员会
CEN-CENELEC 管理中心:Rue de la Science 23, B-1040 Brussels
© 2020 CEN 任何形式和任何方式的使用权归全世
界 CEN 各成员国所有。
参考编号 EN ISO 14155:2020
E
ISO 14155:2020(E)
欧洲前言
本文件(EN ISO 14155:2020)由技术委员会 ISO/TC 194“医疗器械的生物和临床评
价”与 CEN/TC 206 技术委员会“医疗器械的生物和临床评价”合作编写的,其秘书处
由 DIN 管辖。
本欧洲标准最迟应在 2021 年 2 月之前通过发布相同文本或通过背书获得国家标准的地
位,冲突的国家标准最迟应在 2021 年 2 撤销。
注意,此文件的部分内容可能涉及到专利权问题。CEN 不负责识别涉及任何或全部此类
专利的问题。
本文件取代 EN ISO 14155:2011。
本文件是由欧洲委员会和欧洲自由贸易协会授权 CEN 编制的,符合欧盟指令的基本要
求。
与欧盟指令的关系,请参见本文件的资料性附录 ZA 和ZB。
下列引用文件是本文件使用时必不可少的文件。若引用的文件不标日期,则本标准采
用引用文件的最新版本(包括任何修改件)。若引用的标准文件标有日期,则本标准
只采用引用的版本。然而,在使用“附录 ZA 所指的标准”的文件时,用户务必检查所
参考的文件是否尚未被替代以及检查相关内容是否仍被视为公认的最先进技术。
当ISO 标准文本中称为 IEC 或 ISO 标准时,其应理解为相应 EN 标准的规范性引用文件
(如果可用)或 ISO 或 IEC 标准注明日期版本的规范性引用文件,如下所列。
注释 在规范性要求中引用这些参考文档的方式决定了此类文档的适用范围(全部
或部分)。
表 — 未注明日期的规范性引用文件与注明日期的 EN 和 ISO 标准之间的相关性
ISO 标准第2 条中列出的规范
性引用文件
等同的注明日期标准
EN ISO 或 IEC
ISO 14971 EN ISO 14971:2020 ISO 14971:2019
3
ISO 14155:2020(E)
按照 CEN-CENELEC 内部规定,下列国家的国家标准组织必须实施本欧洲标准:奥地
利、比利时、保加利亚、克罗地亚、塞浦路斯、捷克共和国、丹麦、爱沙尼亚、芬
兰、法国、德国、希腊、匈牙利、冰岛、爱尔兰、意大利、拉脱维亚、立陶宛、卢森
堡、马耳他、荷兰、挪威、波兰、葡萄牙、北马其顿共和国、罗马尼亚、塞尔维亚、
斯洛伐克、斯洛文尼亚、西班牙、瑞典、瑞士、土耳其和英国。
认可通知
CEN 批准 ISO 14155:2020 的文本为EN ISO 14155:2020,未作任何修改。
4
摘要:
展开>>
收起<<
欧洲标准ENISO141552020年8月ICS11.100.20取代ENISO14155:2011中文版医疗器械的人类受试者临床研究-临床试验质量管理规范(ISO14155:2020)本欧洲标准于2020年5月2日获得CEN批准。CEN成员必须遵守CEN/CENELEC内部条例,其中规定了赋予本欧洲标准国家标准地位的条件,无任何变更。可以向CEN-CENELEC管理中心或任何CEN成员申请获得关于此类国家标准的最新列表和参考文献。本欧洲标准现有三种官方版本(英文版、法文版、德文版)。由CEN成员国负责翻译成其本国语言并通知CEN-CENELEC管理中心,任何其他语言版本与官方版本具有相同的法...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
IVD产品设计开发以及注册申报流程图VIP免费

 2024-04-12 148
2024-04-12 148 -
医疗器械设计开发控制指南VIP免费

 2024-04-12 220
2024-04-12 220 -
YY∕T 0664-2020医疗器械软件软件生存周期过程核查表VIP免费

 2024-04-12 202
2024-04-12 202 -
创新医疗器械注册申报流程

 2024-05-02 110
2024-05-02 110 -
20221028_医疗器械生产现场核查缺陷分析交流(江苏药省监局审核查验中心) (1)VIP免费

 2024-05-09 73
2024-05-09 73 -
医疗器械网络安全漏洞自评报告VIP专享

 2024-11-18 263
2024-11-18 263 -
内审检查表 MDR法规VIP免费

 2025-04-07 157
2025-04-07 157 -
国产三类医疗器械首次注册-申报前准备工作VIP免费
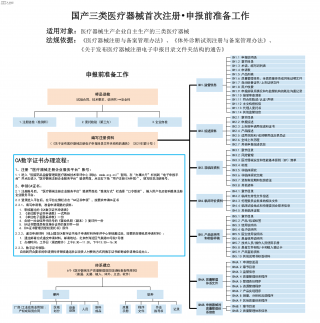
 2025-09-03 19
2025-09-03 19 -
国产三类医疗器械首次注册-申报流程VIP免费
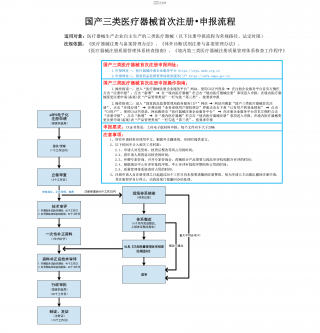
 2025-09-03 23
2025-09-03 23 -
国产三类医疗器械变更注册VIP免费
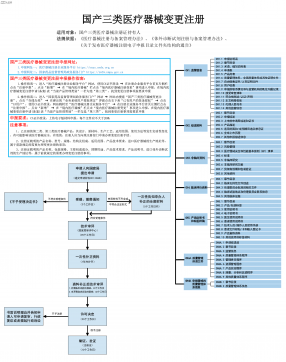
 2025-09-03 18
2025-09-03 18
作者:多多猪
分类:法规规范
属性:85 页
大小:383.03KB
格式:DOCX
时间:2025-08-28


