质量管理体系自查报告模板
VIP免费
《医疗器械生产质量管理规范》自查报告
自查企业名称 (盖章)
自查产品名称 (页面不够可附页)
自查参与人员 自查日期
管理者代表(签名) 企业负责人(签名)
(下表由检查人员填写)
《医疗器械生产质量管理规范》现场核查表
核查企业名称 核查地址
核查产品名称
(含型号、规
格)
核查组长 其他核查人员 核查日期
上海市药品监督管理局编制
说明:
按照《医疗器械生产质量管理规范》的要求,为了提高企业对质量管理体系自我检查的能力,统一检查标准,
制定本自查报告以供参考。企业在申请质量管理体系核查之前,应按照本报告要求进行全面自查,并按要求逐项填
写。
1.企业可以根据申请核查医疗器械的特点、范围、要求,确定相应的检查条款和内容。对“不适用条款”应当说
明“不适用的理由”。核查组予以确认。
2.对自查结果的填写,要求描写可核查的事实。对于只填写“是”“符合”的,可以作为资料不全退回补充。
3.企业承诺对自查情况的真实性负责,并愿意承担任何由于失实而引起的法律后果。
自查结果汇总:
摘要:
展开>>
收起<<
质量管理体系自查报告模板1、医疗器械生产质量管理规范自查表;2、医疗器械生产质量管理规范无菌医疗器械自查表;3、医疗器械生产质量管理规范植入性医疗器械自查表;4、医疗器械生产质量管理规范体外诊断试剂自查表;5、医疗器械生产质量管理规范定制式义齿自查表;6、医疗器械生产质量管理规范独立软件自查表《医疗器械生产质量管理规范》自查报告自查企业名称(盖章)自查产品名称(页面不够可附页)自查参与人员自查日期管理者代表(签名)企业负责人(签名)(下表由检查人员填写)《医疗器械生产质量管理规范》现场核查表核查企业名称核查地址核查产品名称(含型号、规格)核查组长其他核查人员核查日期上海市药品监督管理局编制说明...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
IVD产品设计开发以及注册申报流程图VIP免费

 2024-04-12 148
2024-04-12 148 -
医疗器械设计开发控制指南VIP免费

 2024-04-12 220
2024-04-12 220 -
YY∕T 0664-2020医疗器械软件软件生存周期过程核查表VIP免费

 2024-04-12 202
2024-04-12 202 -
创新医疗器械注册申报流程

 2024-05-02 110
2024-05-02 110 -
20221028_医疗器械生产现场核查缺陷分析交流(江苏药省监局审核查验中心) (1)VIP免费

 2024-05-09 73
2024-05-09 73 -
医疗器械网络安全漏洞自评报告VIP专享

 2024-11-18 263
2024-11-18 263 -
内审检查表 MDR法规VIP免费

 2025-04-07 157
2025-04-07 157 -
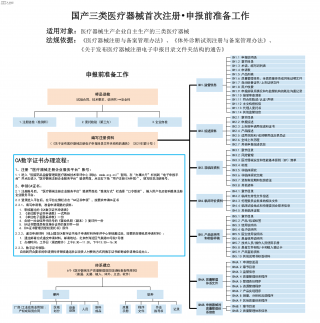
国产三类医疗器械首次注册-申报前准备工作VIP免费
 2025-09-03 19
2025-09-03 19 -
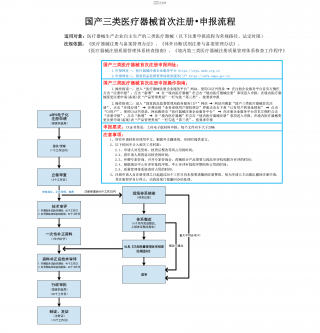
国产三类医疗器械首次注册-申报流程VIP免费
 2025-09-03 23
2025-09-03 23 -
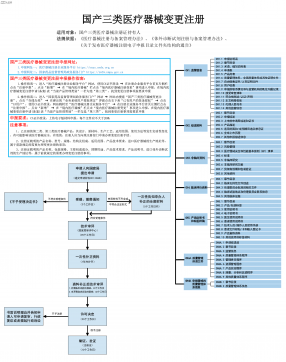
国产三类医疗器械变更注册VIP免费
 2025-09-03 18
2025-09-03 18
作者:多多猪
分类:实用文档
属性:220 页
大小:282.72KB
格式:DOCX
时间:2025-08-30


