MDCG 2020-5临床评价-等同性(中文翻译版)
VIP免费
医 疗 器 械
医疗器械协调组文件 MDCG 2020-5
MDCG 2020-5
临床评价-等同性
提供给制造商和公告机构的指南
2020年4月
本文件已由根据第2017/745号法规第103条成立的医疗器械协调小组(MDCG) 批
准。MDCG 由所有成员国的代表组成,并由欧洲委员会的一名代表担任主席。该文
件不是欧洲委员会的文件,它不能被视为反映了欧洲委员会的官方立场。本文件中所
表达的任何意见均不具有法律约束力,只有欧 洲联盟法院才能对欧洲联盟法律作出
有 约束力的解释。
临床评价-等同性
提供给制造商和公告机构的指南
目录
1.
介绍
...................................................................... 4
2.
范围
..................................................................... 5
3.
等同性
.................................................................... 5
4.
等同性证明
............................................................... 10
5.
使用来自相似器械的数据
.................................................. 14
6. 临床数据识别 ............................................................. 15
附 录
1 :
等 同 性 表
........................................................... 16
摘要:
展开>>
收起<<
医疗器械医疗器械协调组文件MDCG2020-5MDCG2020-5临床评价-等同性提供给制造商和公告机构的指南2020年4月本文件已由根据第2017/745号法规第103条成立的医疗器械协调小组(MDCG)批准。MDCG由所有成员国的代表组成,并由欧洲委员会的一名代表担任主席。该文件不是欧洲委员会的文件,它不能被视为反映了欧洲委员会的官方立场。本文件中所表达的任何意见均不具有法律约束力,只有欧洲联盟法院才能对欧洲联盟法律作出有约束力的解释。临床评价-等同性提供给制造商和公告机构的指南目录1.介绍.....................................................
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
IVD产品设计开发以及注册申报流程图VIP免费

 2024-04-12 148
2024-04-12 148 -
医疗器械设计开发控制指南VIP免费

 2024-04-12 220
2024-04-12 220 -
YY∕T 0664-2020医疗器械软件软件生存周期过程核查表VIP免费

 2024-04-12 202
2024-04-12 202 -
创新医疗器械注册申报流程

 2024-05-02 110
2024-05-02 110 -
20221028_医疗器械生产现场核查缺陷分析交流(江苏药省监局审核查验中心) (1)VIP免费

 2024-05-09 73
2024-05-09 73 -
医疗器械网络安全漏洞自评报告VIP专享

 2024-11-18 263
2024-11-18 263 -
内审检查表 MDR法规VIP免费

 2025-04-07 157
2025-04-07 157 -
国产三类医疗器械首次注册-申报前准备工作VIP免费
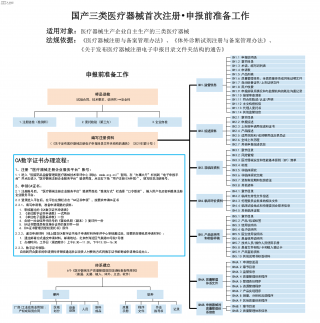
 2025-09-03 19
2025-09-03 19 -
国产三类医疗器械首次注册-申报流程VIP免费
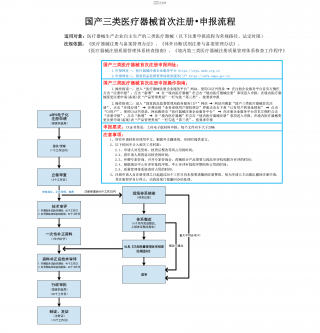
 2025-09-03 23
2025-09-03 23 -
国产三类医疗器械变更注册VIP免费
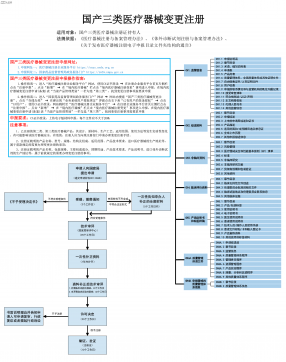
 2025-09-03 18
2025-09-03 18
作者:多多猪
分类:专业资料
属性:20 页
大小:136.5KB
格式:DOC
时间:2025-09-01


