CE临床评价(模板)
VIP免费



摘要:
展开>>
收起<<
更改历史目的本程序概述了临床评价的基本方针和要求。范围本程序适用于所有公司制造的上市前批准的产品。定义职责公司临床研究部门/质量部/研发部/公司的指定代表,按照本程序以及相关法规的要求执行产品临床评价,包括临床研究。质量部负责医疗器械上市后监督系统的信息收集并组织相关部门进行评审。人员资格临床评价方案应由具有医疗器械知识和经验以及熟悉临床知识人员负责编制。临床资料分析应由有经验、有技术的人员、组织或团体进行。程序产品项目评审小组根据设计控制程序决定是否需要产品临床评价。所有新产品开发在第二阶段设计评审时确定临床评价策略。作为指引方针,应当在下述条件下开展临床评价:体外测试结果不能确定医疗器械的...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
IVD产品设计开发以及注册申报流程图VIP免费

 2024-04-12 148
2024-04-12 148 -
医疗器械设计开发控制指南VIP免费

 2024-04-12 220
2024-04-12 220 -
YY∕T 0664-2020医疗器械软件软件生存周期过程核查表VIP免费

 2024-04-12 202
2024-04-12 202 -
创新医疗器械注册申报流程

 2024-05-02 110
2024-05-02 110 -
20221028_医疗器械生产现场核查缺陷分析交流(江苏药省监局审核查验中心) (1)VIP免费

 2024-05-09 73
2024-05-09 73 -
医疗器械网络安全漏洞自评报告VIP专享

 2024-11-18 263
2024-11-18 263 -
内审检查表 MDR法规VIP免费

 2025-04-07 157
2025-04-07 157 -
国产三类医疗器械首次注册-申报前准备工作VIP免费
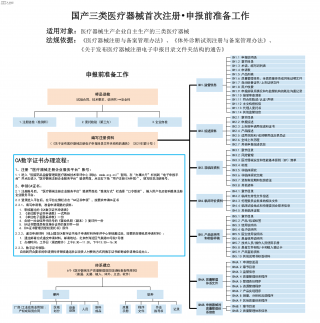
 2025-09-03 19
2025-09-03 19 -
国产三类医疗器械首次注册-申报流程VIP免费
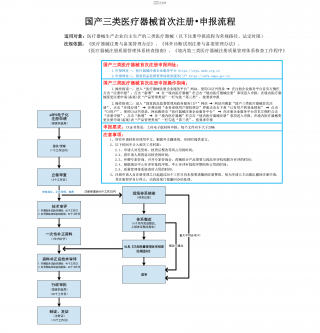
 2025-09-03 23
2025-09-03 23 -
国产三类医疗器械变更注册VIP免费
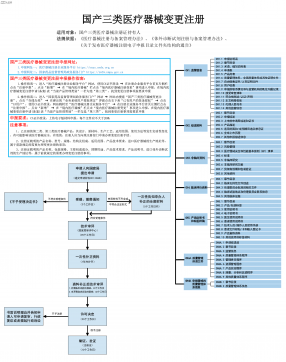
 2025-09-03 18
2025-09-03 18
作者:盛夏阳光
分类:专业资料
属性:6 页
大小:41.05KB
格式:DOCX
时间:2025-05-20


